La maturazione di tutte le cellule del sangue avviene all'interno del microambiente del midollo osseo, un tessuto molle che riempie le cavità delle ossa, composto da una rete di componenti della matrice extracellulare e fluidi intercellulari generati dai gradienti di pressione provenienti dal sistema vascolare che facilitano il processo di emopoiesi.
I disturbi piastrinici, che colpiscono circa 3 milioni di persone in tutto il mondo, comprendono una vasta gamma di malattie rare che possono rimanere non diagnosticate o diagnosticate erroneamente per anni. Attualmente, le malattie piastriniche ereditarie comportano molteplici malattie monogeniche rare da mutazioni in più di 60 geni specifici di grado diagnostico.
L'analisi della produzione e delle dimensioni piastriniche svolge un ruolo cruciale nel guidare la diagnosi differenziale.
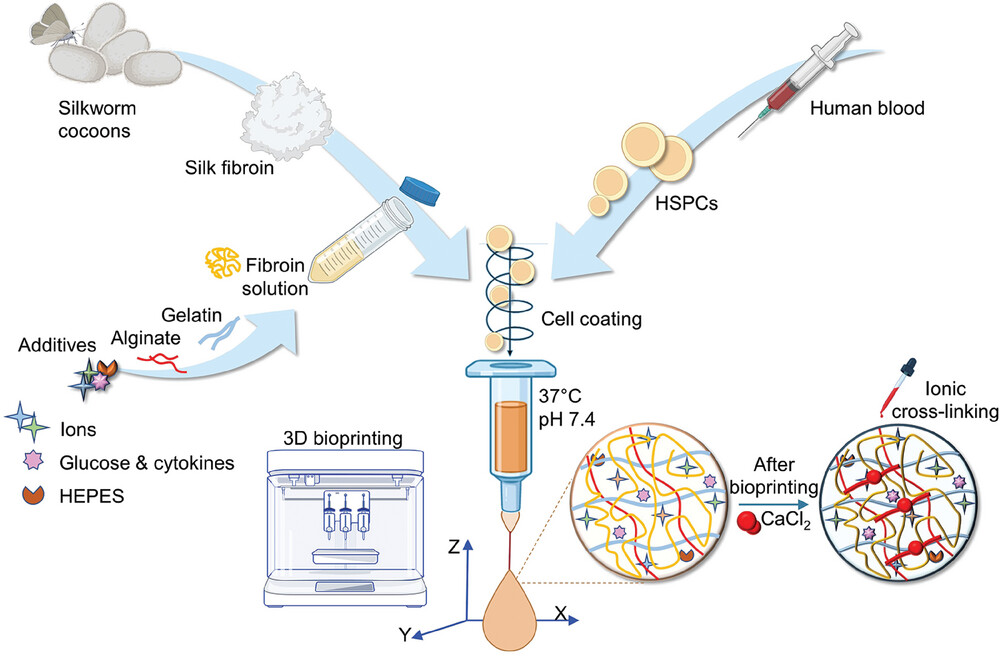
Le HSPC (cellule staminali pluripotenti umane) sono fragili e richiedono un ambiente chimico-fisico e meccanico definito per sopravvivere e differenziarsi al di fuori del corpo umano. È stato progettato un bioink su misura per supportare il bioprinting delle cellule progenitrici del sangue in condizioni fisiologicamente rilevanti (37 °C, pH 7.4) e fornire un microambiente 3D biomimetico stabile che ne sostenga la sopravvivenza, la differenziazione e la maturazione. Nello specifico, una soluzione di fibroina di seta rigenerata, proveniente da bozzoli naturali di bachi da seta di Bombyx mori, è stata miscelata con gelatina e alginato di sodio e, per fornire carburante al metabolismo cellulare, il sistema è stato alimentato con glucosio.
L’inchiostro è stato estruso attraverso una testina riscaldata a 37 °C e deposto su un letto di stampa freddo (<25 °C) per avviare la termoindurenza, ad una velocità di 8-10 mm/s, pressione pneumatica di 12-16 kPa e attraverso un ugello di 20G. I costrutti 3D gelificati sono stati subito dopo immersi in una soluzione tampone salina contenente CaCl2 per reticolare l'alginato.
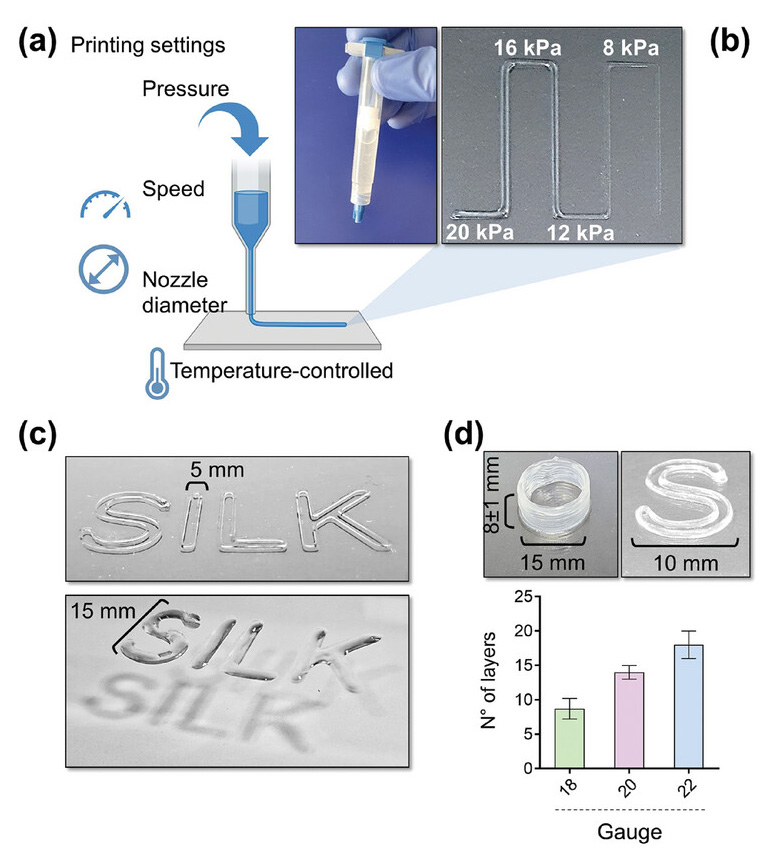
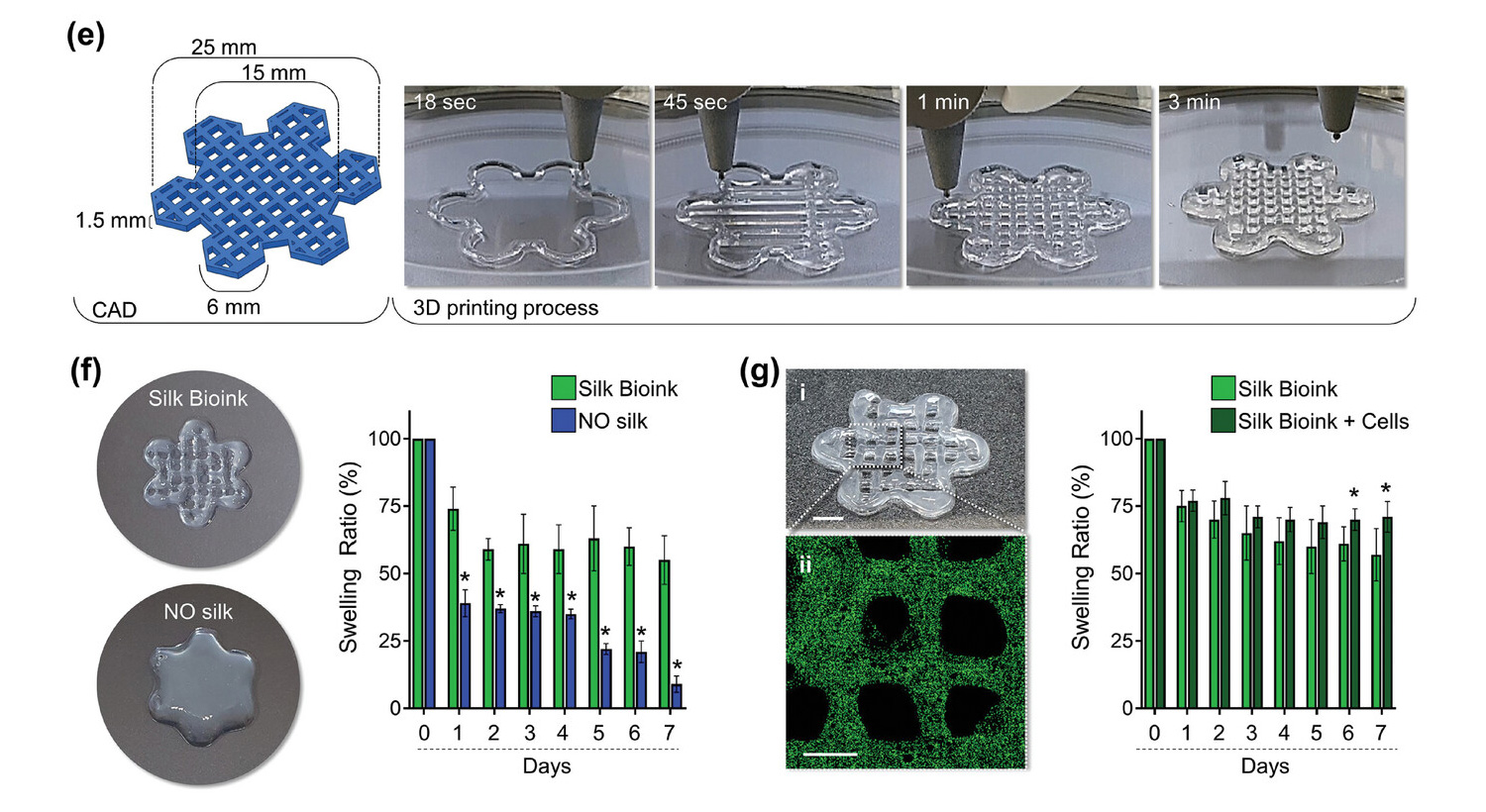
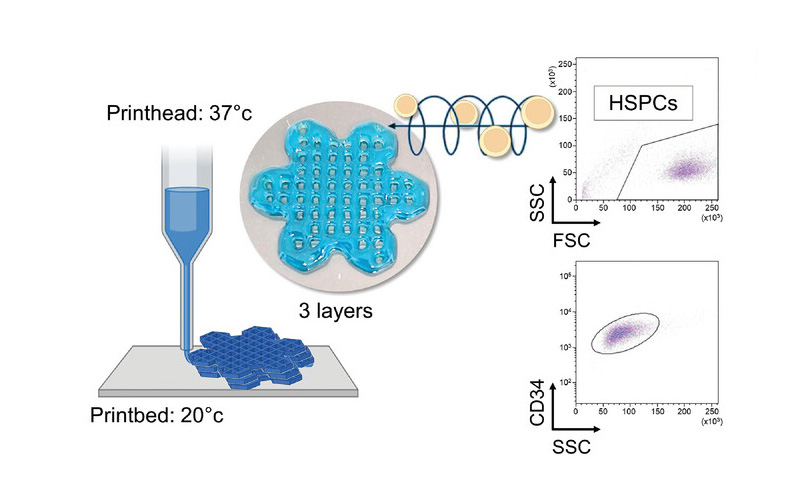
Il modello 3D stampato rappresenta una griglia esagonale stratificata che interseca esagoni più piccoli ai suoi bordi per simulare una struttura simile a un fiore che imita la rete microvascolare per facilitare lo scambio di nutrienti, ossigeno e prodotti di scarto all'interno del tessuto stampato, migliorando così la sopravvivenza e la funzione cellulare.
La forma dei costrutti stampati è risultata altamente coerente e corrispondente ai valori di input con un'eccellente consistenza dell'estrusione e stabilità strutturale durante tutto il processo di stampa, risultato in netto contrasto con il bioink senza seta, che si è fuso rapidamente dopo la deposizione, con conseguente fusione degli strati per formare strutture di caratteristiche scarsamente definite.
La ricostruzione al microscopio confocale ha mostrato che le cellule si sono distribuite in modo omogeneo nella struttura 3D e l'integrità del bioink di seta è stata mantenuta durante la coltura, senza cambiamenti importanti dello swelling ratio.
Il live/dead staining, eseguito immediatamente dopo il bioprinting, ha rivelato una popolazione altamente vitale. Inoltre, è stato sviluppato un buffer su misura per dissolvere il costrutto 3D. Quando le HSPC sono state recuperate dal costrutto disciolto, la vitalità cellulare era ben conservata, senza differenze significative nel tempo (giorno 2 (93 ± 3%) e giorno 7 (93 ± 4%)).
L'imaging 3D ha dimostrato un microambiente cellulare vivente in cui le cellule, quando coltivate in presenza di trombopoietina, si sono trasformate da progenitori diploidi a megacariociti poliploidi, fenotipicamente analoghi a quelli osservati nel tessuto nativo del midollo osseo. Un'analisi approfondita della citometria a flusso delle cellule, recuperate dal bioink di seta, ha mostrato l'espressione dell'intero spettro di marcatori di superficie dei megacariocitici: più dell’85% delle cellule esprimono CD29, CD41, CD42a, CD42b, CD49b, CD49d e CD61. Il trascritto dei geni per i componenti della matrice extracellulare (ad esempio, fibronectina, collagene di tipo III e collagene di tipo IV) e per gli enzimi di rimodellamento della matrice (ad esempio, MMP2 e MM9), è aumentato nel corso della maturazione, dimostrando l'adattamento fisiologico delle cellule che hanno replicato fedelmente il processo di differenziazione dei megacariociti come avviene all'interno del corpo umano.
L'imaging ad alta risoluzione a livello di singola cellula ha dimostrato che, durante la maturazione, i megacariociti subiscono un sostanziale cambiamento di forma, da una morfologia rotonda regolare a forme irregolari che invadono il microambiente 3D. L'analisi volumetrica della coltura 3D ha stabilito che i progenitori a basso volume, che mostrano un alto indice di sfericità media, si trasformano in grandi megacariociti, che aumentano significativamente il loro volume perdendo sfericità a favore di margini altamente ramificati, che ricordano la formazione di pro-piastrine.

È noto che i megacariociti del midollo osseo sintetizzano lipidi e colesterolo che forniscono membrane fluide per allungare le pro-piastrine. Le ricostruzioni 3D delle cellule hanno mostrato che le pro-piastrine, arricchite di colesterolo lungo la loro lunghezza, si assottigliano attraverso lo spazio 3D e rilasciano attivamente particelle di dimensioni piastriniche con marcatori CD41a+ e CD42a+.
È stato applicato questo approccio di bioprinting ai megacariociti derivati da pazienti che avevano precedentemente ricevuto una diagnosi di malattia correlata a MYH9 (RD) e trombocitopenia correlata a ANKRD26 (RT), due forme di trombocitopenia ereditaria caratterizzate da una bassa conta piastrinica da moderata a grave.
Inoltre, sono state incorporate reazioni enzimatiche nel bioink di seta direttamente nella formulazione per tracciare il metabolismo cellulare tramite quantificazioni colorimetriche in grado di fornire una misurazione standardizzata, rapida e non distruttiva della funzione cellulare e della produzione di piastrine nel costrutto 3D. Come indicatore di prova è stato scelto il livello di lattato a causa dell'intima connessione tra il metabolismo del glucosio megacariocitario e la generazione di piastrine. La via glicolitica e il ciclo di Krebs svolgono un ruolo cruciale nel supportare la specificazione del lignaggio, la moltiplicazione nucleare e l'accumulo di membrane necessarie per il successo della trasformazione dei megacariociti in piastrine funzionali, facilitando la sintesi di glicoproteine, nucleotidi e lipidi. È stato incorporato l'HRP nella formulazione del bioink di seta per valutare la stabilità dell'enzima nel suo formato stampato in 3D. I costrutti sono stati conservati a 4, 37 o 70 °C per 15 giorni e un'emissione di chemiluminescenza comparabile ha dimostrato la capacità del bioink a base di seta di preservare l'attività enzimatica complessiva.

In conclusione, è stato sviluppato un approccio completo per la biostampa 3D di cellule progenitrici del sangue umano in modo standardizzato e automatizzato. Questa metodologia ha facilitato la creazione di modelli 3D caratterizzati da proprietà meccaniche altamente riproducibili, integrità strutturale e distribuzione uniforme delle celle. Questi progressi hanno migliorato la funzione dei megacariociti, portando a una migliore produzione di piastrine.
Queste conoscenze possono contribuire a una comprensione più profonda dei meccanismi patogenetici sottostanti, guidare la definizione delle priorità delle strategie per lo sviluppo di farmaci e aprire la strada allo screening ad alto rendimento di nuove opzioni terapeutiche direttamente sui progenitori del sangue dei pazienti.
Fonte: PubMed Central