Il tessuto muscolare scheletrico (SMT) è l'organo più grande per massa del corpo umano ed è fondamentale per la locomozione, la postura, la respirazione, la fisiologia e l'omeostasi energetica. Le malattie genetiche o acquisite, così come i danni e l'invecchiamento, possono rendere questo organo disfunzionale e causare una significativa compromissione della qualità della vita e della salute umana.
Negli ultimi tre decenni, sono stati sviluppati diversi sistemi di coltura SMT tridimensionali per imitare il microambiente del muscolo nativo e comprendere la funzione, la plasticità e la malattia del muscolo scheletrico.
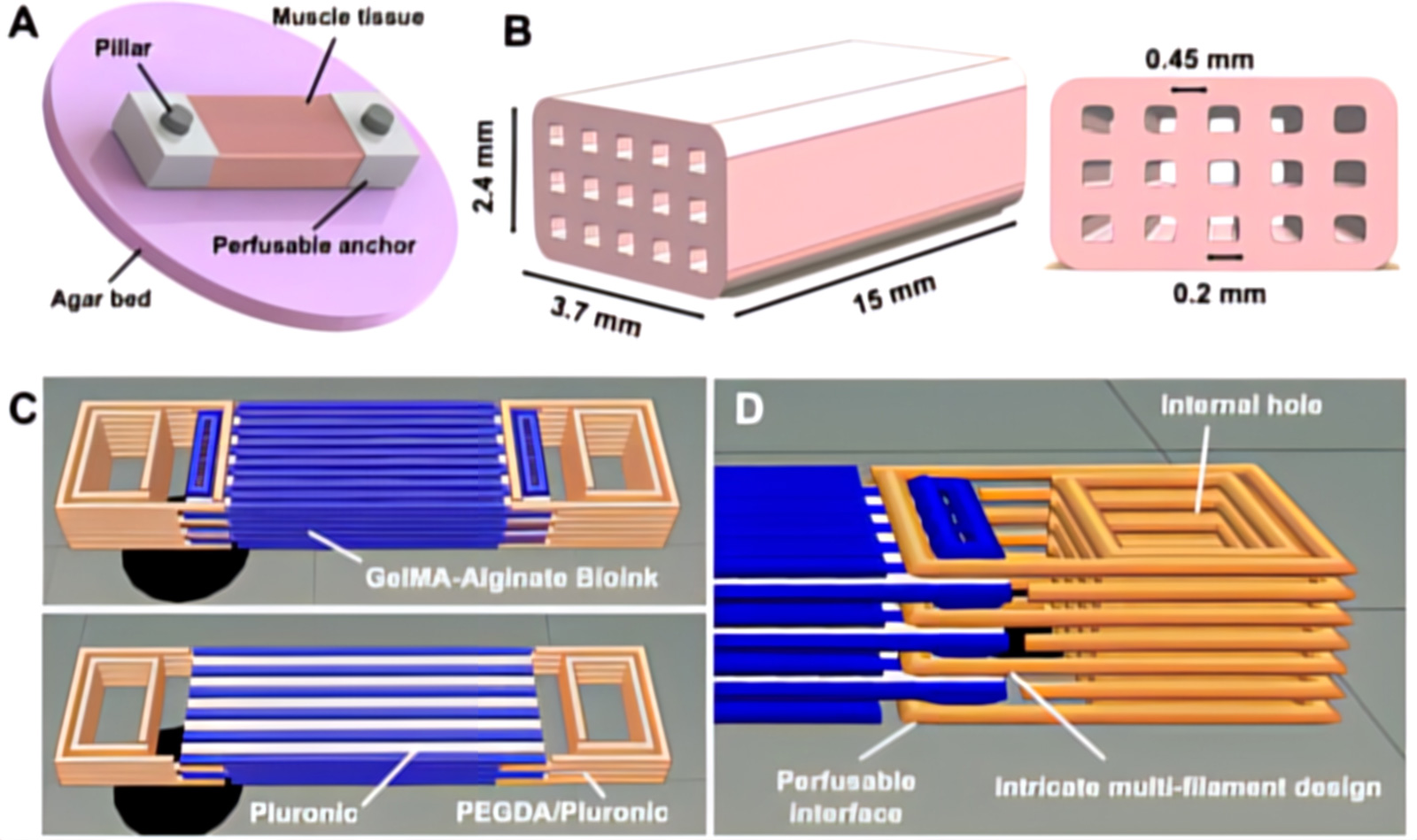
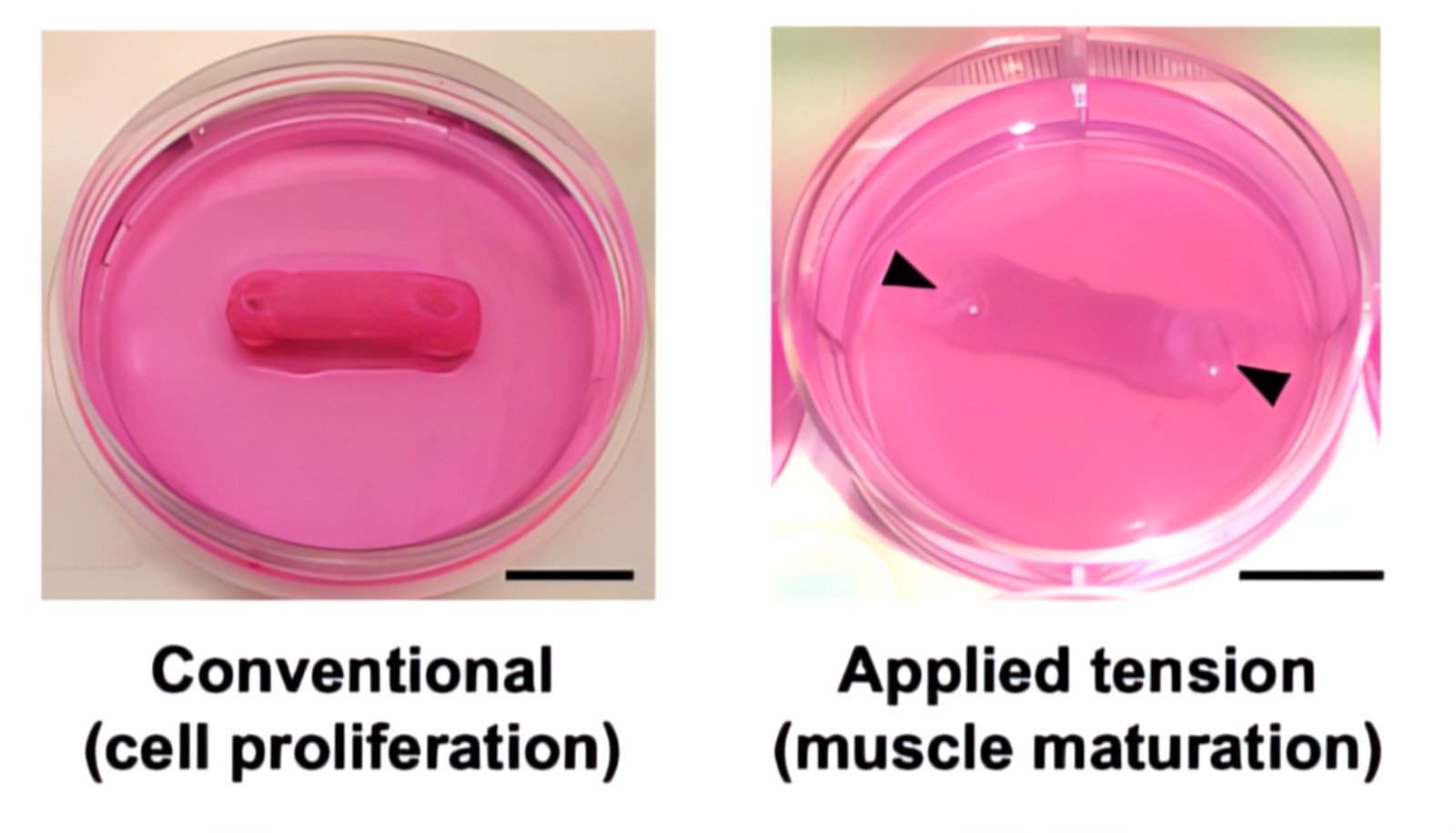
La biostampa 3D basata sull'estrusione multimateriale è stata utilizzata per realizzare SMT idonei alla perfusione e bioibridi. Per conferire tensione meccanica per la maturazione muscolare, i costrutti sono stati fissati durante la fase di differenziazione a letti di agar sul fondo dei pozzetti di coltura. I pilastri sono stati fatti passare attraverso i fori di ancoraggio dell'SMT e perforati nell'agar.
L'SMT biostampato consiste in una struttura di tessuto multistrato con una dimensione nominale di 3,7×2,4×15 mm ed è stato riempito con microcanali interni con un diametro di 200 μm generati all'interno dei costrutti tramite un inchiostro sacrificale (bianco) composto da Pluronic F-127 stampato simultaneamente con il bioink a base di GelMA all'8% e NaAlg al 7% carico di cellule muscolari scheletriche (25×106 cellule/mL) (blu) e poi rimosso dopo la stampa esponendo i costrutti a una temperatura inferiore al suo punto di gelificazione.
Oltre ai canali, il tessuto è stato co-stampato con strutture di ancoraggio integrate composte da una miscela di PEGDA e Pluronic F-127, che sono servite a fissare il costrutto ai modelli di coltura utilizzati per la maturazione dei tessuti. Gli ancoraggi sono stati progettati con un'interfaccia interna in grado di consentire la perfusione dei microcanali del blocco centrale lasciati dopo la rimozione dell'inchiostro sacrificale. Per stabilizzare l'interfaccia, l'inchiostro di ancoraggio (arancione) è stato modellato in modo da intrecciarsi con il bioinchiostro e da formare anche un foro centrale che funge da punto di inserimento per stabilizzare i pilastri nella dima di maturazione.
Gli inchiostri sono stati estrusi attraverso ugelli conici con un diametro interno di 410 μm (22G). Per mantenere sia la GelMA che la Pluronic F-127 nel loro stato termicamente gelificato, la temperatura del piano di stampa è stata impostata a 19 °C. Le miscele GelMA-NaAlg sono state stampate con la testina di stampa a temperatura controllata e mantenute a 21 °C per tutta la durata della stampa. Il bioink caricato di cellule è stato stampato a una velocità di 10 mm/s e a una pressione dell'aria di 30 kPa.
Il bioink sacrificale è stato stampato a una velocità di 8 mm/s a 75 kPa. Per stampare le ancore, un inchiostro basato su PEGDA 700 e Pluronic F-127 è stato stampato a velocità di erogazione di 75 mm/min e pressione di 780 kPa. Ogni strato è stato fotoreticolato direttamente dopo la stampa a 365 nm per 30 secondi. Dopo aver stampato tutti e sette gli strati, i costrutti sono stati immersi in una soluzione di CaCl2 per 45 secondi). Poiché Pluronic F-127 ha una bassa temperatura critica di gelificazione (circa 14°C), il lavaggio dei costrutti con l'agente reticolante ghiacciato ha contemporaneamente eliminato l'inchiostro sacrificale e reticolato la porzione di alginato dell'idrogel.
Il bioink è risultato sufficientemente morbido per supportare la stampa e la coltura dei mioblasti e poteva essere stampato con una precisione del 90%. La larghezza della linea del bioink e dell'inchiostro sacrificale è rispettivamente di circa 450 e 200 μm e il loro coprinting ha permesso di creare architetture vicine al design del target con un'elevata fedeltà strutturale. In particolare, sono stati osservati microcanali paralleli che corrono lungo l'asse longitudinale dei costrutti, aperti alle estremità e contigui allo spazio esterno.
La vitalità delle cellule post-stampa ha dimostrato che le cellule hanno mantenuto un'elevata vitalità (> 90%) in tutti i tipi di disegni biostampati. Questo risultato suggerisce che la presenza degli inchiostri per i canali e gli ancoraggi, così come i relativi protocolli di bioprinting, non hanno alterato sostanzialmente la vitalità cellulare. Per valutare la proliferazione cellulare nel tempo, gli interi costrutti sono stati analizzati ai giorni 3, 6 e 15. L'elevata vitalità cellulare è stata riscontrata in tutti i progetti e le condizioni di costruzione. Tuttavia, nei design con canali (+Ch/+Anc/+Tens; +Ch/-Anc/-Tens; +Ch/+Anc/-Tens), sono state rilevate quantità inferiori di globuli rossi morti rispetto alle condizioni senza canali (-Ch/+Anc/+Tens; -Ch/-Anc/- Tens).
Oltre i 200 μm di profondità, i costrutti senza canali hanno mostrato una morte cellulare distribuita su un'ampia area. Al contrario, i costrutti con canali avevano meno cellule morenti che erano anche localizzate all'interno di aree circoscritte, suggerendo che la presenza di canali supporta la vitalità cellulare. Inoltre, l'imaging ha mostrato l'effetto della tensione meccanica durante la fase di differenziamento sul cambiamento morfologico delle cellule verso la formazione di miotubi. I costrutti sottoposti a tensione meccanica (+Ch/+Anc/+Tens; -Ch/+Anc/+Tens) hanno mostrato un forte allineamento cellulare nei giorni 3 e 6 e miotubi lunghi e vitali a diverse profondità tissutali (100 e 500 μm) il giorno 15.
In assenza di stress meccanico (+Ch/-Anc/-Tens; -Ch/-Anc/-Tens; +Ch/+Anc/-Tens), le cellule si sono allineate solo in misura limitata nella fase di maturazione precoce (giorno 6) e nessun miotubo vitale evidente era visibile nella fase di maturazione successiva (giorno 15).
Al termine del processo di maturazione (giorno 15), i costrutti canalizzati erano ancora idonei alla perfusione con cinetica più veloce rispetto a un muscolo solido senza canali. I costrutti bioibridi maturi canalizzati sono stati completamente perfusi dalla soluzione colorante dopo soli 30 minuti di esposizione alla colorazione, mentre i costrutti maturati in assenza di canali sono stati completamente colorati dopo 10 ore di esposizione alla colorazione.

Il design stampato con PEGDA/Pluronic e GelMA/NaAlg è risultato abbastanza robusto da resistere a forze dell’ordine dei μN e mN, che sono tipiche dei bioattuatori di dimensioni simili. Inoltre, la modellazione di reti per la perfusione all'interno dei costrutti non solo ha ridotto la presenza di regioni ipossiche senza alterare la stabilità strutturale dell'assieme, ma ha anche fornito una guida di contatto ai miociti in crescita, promuovendo la formazione di fibre muscolari allineate unidirezionalmente.
Fonte: Wiley online library